-
组织切片的高质量单细胞转录组学揭示了小鼠卵泡的组织学相关异质性
2023-09-25 15:57:31 生活 -
导读 奈良医科大学胚胎学系 Kazuki Kurimoto 教授和 Hiroki Ikeda 助理教授领导的研究小组开发了一种高灵敏度的定量单细胞转录组分析方法...
奈良医科大学胚胎学系 Kazuki Kurimoto 教授和 Hiroki Ikeda 助理教授领导的研究小组开发了一种高灵敏度的定量单细胞转录组分析方法,可以使用激光捕获精确检查从组织切片中提取的细胞显微切割(LCM),并将该方法命名为 DRaqL(直接 RNA 回收和猝灭 LCM)。此外,该方法允许对 mRNA 的外显子-外显子连接进行定量。在 DRaqL 在小鼠卵巢切片中的应用中,研究小组根据卵母细胞的直径建立了卵母细胞转录组的预测模型。值得注意的是,与该预测模型的偏差揭示了卵母细胞基因表达谱的生长迟缓。这项研究还揭示了颗粒细胞的基因表达差异,取决于它们与卵母细胞的接近程度。这项研究首次在单细胞水平上对卵泡发生过程中转录组与组织学之间的关系进行了全面的定量分析。
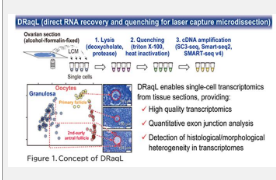
【研究背景】
包括人类在内的多细胞生物从单个受精卵开始发育。因此,卵母细胞的质量控制对于生命的稳定遗传至关重要,尽管其潜在机制仍然是个谜。卵母细胞被称为颗粒细胞的支持细胞包围,形成卵泡。在小鼠卵巢中,卵母细胞的尺寸大幅增加,直径从小于 20 μm 到超过 70 μm。颗粒细胞通过提供各种物质来培育卵母细胞并支持其生长而发挥着至关重要的作用。为了揭示控制卵母细胞形成的复杂机制,重要的是在它们的组织学特征(例如它们与颗粒细胞的空间关系及其大小)与卵母细胞和颗粒细胞的精确转录组数据之间建立联系。
近几十年来,出现了许多单细胞转录组学方法,为生命和细胞过程的复杂运作提供了深刻的见解。尽管如此,这些技术大多数依赖于细胞与组织的分离,导致组织学信息丢失的结果。
为了解决这些限制,空间转录组学技术最近取得了进展,能够在组织切片上进行基因表达分析,同时保留位置信息。这些方法显着增强了空间分辨率,达到单细胞水平甚至更高的分辨率。然而,值得注意的是,空间转录组学方法在单细胞水平的基因表达分析质量方面涉及权衡。这些权衡包括一些挑战,例如量化 mRNA 同种型分析的外显子-外显子连接、相对较低的灵敏度以及实现无偏转录组分析的困难(通常是由于基于探针的分析设计)。而且,许多空间转录组学技术需要将组织切片安装到专为转录组分析而设计的昂贵的载玻片上。这使得根据组织形态的显微镜检查选择合适的切片进行基因表达分析变得具有挑战性。此外,一次性分析整个切片的高度可扩展的空间转录组方法在处理大量组织切片时可能会变得非常昂贵。此外,将这些切片重新用于其他目的(例如提取基因组 DNA 或蛋白质)变得具有挑战性。一次性分析整个切片的方法在处理大量组织切片时可能会变得非常昂贵。此外,将这些切片重新用于其他目的(例如提取基因组 DNA 或蛋白质)变得具有挑战性。一次性分析整个切片的方法在处理大量组织切片时可能会变得非常昂贵。此外,将这些切片重新用于其他目的(例如提取基因组 DNA 或蛋白质)变得具有挑战性。
另一方面,采用激光捕获显微切割(LCM)或类似技术从组织切片中精确切割和收集细胞(或细胞碎片),然后将其裂解以进行后续的基因表达分析。这种方法为当前的空间转录组学方法提供了补充特征。除了上述实际可用性之外,基于 LCM 的转录组分析原则上还有可能以与常规转录组分析相同的精度来量化组织切片中的单细胞转录组。鉴于基于 LCM 的转录组学的广泛使用,提高其精度和灵敏度有望显着推进各种医学和生命科学研究工作。
然而,组织形态的显微分析需要用酒精或福尔马林固定的切片进行染色,以防止染色实验过程中细胞内容物的洗脱。使用传统方法,从固定组织切片中提取 RNA 的效率并不总是最佳。这些挑战影响了组织切片单细胞转录组分析的准确性和灵敏度。
【研究成果】
在这项研究中,我们开发了一种有效的方法来裂解从酒精或福尔马林固定的组织切片中分离的细胞(或细胞碎片),并将裂解物直接应用于RNA测序(RNA-seq)。该技术涉及用两种类型的洗涤剂处理固定的组织切片:变性洗涤剂和非变性洗涤剂。最初,使用第一种变性去污剂脱氧胆酸钠有效裂解细胞。随后,添加大量的第二种非变性去垢剂 Triton X-100,以抵消初始去垢剂的变性作用(图 1)。该过程有利于有效的细胞裂解和后续 RNA-seq 所需的酶促反应。此外,当与蛋白酶处理相结合时,即使是用福尔马林牢固固定的组织切片也可以有效裂解。
为了评估使用 DRaqL 进行转录组分析的敏感性,我们对使用 LCM 从小鼠卵巢切片以及由同质培养细胞组成的细胞块中分离的单细胞进行了 RNA 测序。为了进行比较,我们对从同一样本(同一小鼠的另一个卵巢或同一培养批次)获得的新鲜分离的细胞进行了 RNA 测序,无需切片和固定(图 2)。
比较这些转录组数据集表明,来自组织切片的单细胞 RNA-seq 的敏感性与来自新鲜分离细胞的单细胞 RNA-seq 的敏感性几乎相同。此外,两种方法之间的表达模式相似。此外,我们还验证了基于 DRaqL 的单细胞 RNA-seq 对 mRNA 外显子-外显子连接的定量能力。
此外,DRaqL 与蛋白酶处理的结合可以分析用福尔马林牢固固定的组织切片中的单细胞。该分析表现出比现有方法更高的灵敏度,并且表现出类似于新鲜分离细胞的表达模式。这些发现强调了 DRaqL 实现高质量单细胞转录组分析的能力。
此外,利用 DRaqL,我们探索了小鼠卵泡的形态与其成分(即卵母细胞和颗粒细胞)转录组之间的关系(图 3)。这项研究揭示了生长的卵母细胞的大小(直径)与其转录组之间的连续相关性,从而能够开发基于卵母细胞大小的卵母细胞转录组的预测模型。利用这个模型,我们鉴定出了偏离预测模式的卵母细胞,显示出相对于其形态生长而言不成熟的转录组。这一发现可能与优势卵泡选择有关,在这一过程中,只有优势卵泡在卵泡发育过程中进展并最终达到排卵。
此外,我们着眼于颗粒细胞与卵母细胞之间的空间关系,对靠近卵母细胞和远离卵母细胞的颗粒细胞进行了比较分析。这项检查揭示了根据与卵母细胞的接近程度而差异表达的基因,包括与转录和细胞增殖相关的调节因子。
结合卵巢卵泡形态进行定量单细胞转录组学的能力依赖于本研究中完成的组织切片的精确显微镜检查与高质量转录组分析的结合。未来,使用 DRaqL 进行转录组分析的进一步发展预计将为生育治疗和辅助生殖医学做出重大贡献,包括识别与卵泡和卵母细胞质量控制相关的因素。
标 签:
免责声明:本文由用户上传,如有侵权请联系删除!




















